Article de synthèse
Auteur(s) : Aurélie Allard
Fonctions : Docteur en médecine vétérinaire et membre du Collège européen de reproduction animale
13, rue du Merle
71250 Cluny
Avec l’abondance d’informations disponibles sur Internet, les praticiens vétérinaires sont confrontés aux questions de plus en plus pointues des éleveurs et des propriétaires de chevaux sur la reproduction.
Afin de répondre avec précision aussi bien sur l’existence que sur la disponibilité d’une technique ou d’un traitement en reproduction équine, un tour d’horizon de l’actualité glanée dans les congrès de 2012 et des derniers travaux publiés dans le monde entier permet une mise au point sur le sujet. De nouvelles méthodes appliquées dans la recherche pourraient prochainement se développer sur le terrain pour améliorer les résultats du transfert embryonnaire. Des traitements et des outils diagnostiques innovants sont aujourd’hui disponibles pour faciliter la détection de la cryptorchidie et des tumeurs ovariennes, ainsi que le contrôle du comportement sexuel. Enfin, une présentation sur l’injection intracytoplasmique de spermatozoïdes (ICSI) montre l’intérêt et les limites de cette technique en reproduction équine.
En 2012, en France, pas moins de 808 juments receveuses ont été déclarées gravides (données Sire). Ce nombre sous-estime celui des embryons collectés et transférés car, souvent, la déclaration de premier saut (DPS) n’est complétée qu’une fois la gestation confirmée à 14 jours. Il y a 15 ans, le transfert embryonnaire était une technique de pointe réservée aux spécialistes. À ce moment-là, le transfert de l’embryon dans la corne utérine se faisait par une laparotomie sur les flancs. Désormais, les embryons sont transférés via le col utérin, méthode moins invasive qui permet d’obtenir des taux de gestation d’environ 80 % pour un opérateur expérimenté et exercé.
Une nouvelle technique, le diagnostic préimplantatoire (DPI), pourrait faire partie intégrante d’un programme de transfert embryonnaire. En médecine humaine, il permet de détecter les anomalies chromosomiques des embryons conçus après fécondation in vitro par biopsie d’un ou de deux blastomères d’un jeune embryon ou de cellules du trophoblaste d’un blastocyste. Chez le cheval, le DPI permettrait de dépister :
– les embryons homozygotes pour les maladies génétiques récessives telles que l’asthénie cutanée régionale équine héréditaire (HERDA), la paralysie périodique hyperkaliémique (HYPP), la myopathie atypique équine et la glycogénose hépatique (GBDE) des quarter horses, ou encore l’immunodéficience sévère combinée (SCID) et l’atrophie cérébelleuse chez les chevaux de race arabe ;
– le sexe de l’embryon ;
– la robe du poulain à venir [10, 17, 18].
Une des limites à la biopsie embryonnaire dans l’espèce équine est la difficulté et le coût élevé de la production d’embryons in vitro. L’analyse doit donc être réalisée sur des embryons récoltés par lavage utérin au stade du blastocyste [18]. Les premiers travaux de biopsie embryonnaire réalisés sur des blastocystes ont donné des taux de gestation de 20 % [21]. En 2012, les études publiées ont fait état de taux de gestation compris entre 20 et 100 %. Elles ont montré qu’il est possible de déterminer avec succès le sexe d’un embryon par PCR (polymerase chain reaction) à partir de quelques cellules biopsiées de la périphérie du trophoblaste, dans 82 à 88 % des cas et avec une fiabilité de 100 % [14, 15, 26]. À la suite de la biopsie, les blastocystes présentent un collapsus transitoire de leur blastocèle qui se reforme après 3 heures de culture [17].
Le développement du DPI peut être limité par la nécessité de transporter l’embryon jusqu’à un laboratoire en mesure d’effectuer la biopsie. Accomplir l’analyse PCR en moins de 6 heures est un atout non négligeable pour le développement commercial du DPI, afin de pouvoir réaliser le transfert juste après le résultat de la PCR [26]. Si l’analyse prend plus de 24 heures, il est préférable de congeler l’embryon en attendant les résultats. Par exemple, l’université Texas A&M (College Station, Texas) reçoit des blastocystes de centres de collecte d’embryons, conservés au plus une nuit à 38 °C. Les cellules sont biopsiées, puis envoyées à l’université de Californie (Davis, Californie) qui pratique les analyses génétiques du DPI.
L’embryon est ensuite retourné au centre de transfert, ou bien transféré ou congelé au sein du laboratoire de l’université Texas A&M [18].
La technique de transfert embryonnaire s’est développée avec la possibilité de réfrigérer et de transporter les embryons en moins de 24 heures, les petits embryons (morula, jeunes blastocystes) supportant moins bien la réfrigération que les blastocystes épanouis (encadré 1) [24]. Toutefois, il reste encore une limite au transfert embryonnaire : la difficulté de synchroniser les chaleurs des donneuses et des receveuses. La cryoconservation des embryons permettrait de s’affranchir de cette lourde gestion en dissociant dans le temps et dans l’espace la collecte et le transfert. Elle autorise également le développement des échanges internationaux de matériel génétique. Pourtant, à ce jour, peu d’embryons sont congelés : moins de 2 % dans le monde en 2010 [30]. Un état actuel des connaissances en congélation d’embryons équins permet de comprendre pourquoi il est difficile de les congeler.
Le premier poulain conçu d’un transfert d’embryon cryoconservé par congélation lente est né en 1982 [32]. Douze ans plus tard, des gestations ont été obtenues après vitrification d’embryons et, récemment, la naissance de deux ânons a été publiée [20, 25]. En résumé, les taux de gestation sont en moyenne de 28 % pour les embryons de taille inférieure à 300 µm qui font l’objet d’une congélation lente et de 60 % pour la vitrification (photo 1) [5]. Jusqu’à il y a quelques années, les embryons de taille supérieure à 300 µm ont conduit à des taux de gestation compris entre 0 et 38 % quelle que soit la technique utilisée [18].
Pourquoi est-il difficile de congeler les embryons équins ? En raison du coût. Il est extrêmement long et onéreux de produire le grand nombre d’embryons nécessaire à une étude comparative. En moyenne, les lots sont de 10 embryons là où 50 ou 100 sont nécessaires. Les blastocystes équins possèdent un plus grand nombre de cellules, comparativement aux autres espèces au même stade de développement. Autre particularité liée à l’espèce équine, des embryons du même “âge” ne comportent pas le même nombre de cellules. Les embryons présentent une grande activité mitotique et pourraient alors être plus sensibles à l’effet délétère de la cryoconservation sur le cytosquelette. De plus, les cellules sont riches en gouttelettes lipidiques, facteur limitant la résistance à la congélation. La capsule qui se forme autour de l’embryon équin dès son entrée dans l’utérus empêcherait le passage du cryoprotecteur, ce qui entraînerait une protection insuffisante et/ou des dommages osmotiques (photo 2) [5]. Enfin, les blastocystes épanouis, de gros diamètre, contiennent beaucoup de liquide dans leur blastocèle (photo 3). Ils représentent un volume important difficile à congeler [18].
Nous avons vu précédemment qu’un blastocyste perd le liquide du blastocèle au moment de la biopsie du trophoblaste. À la suite de cette micromanipulation, le volume de l’embryon diminue, lequel contient beaucoup moins de liquide. La capsule présente également une brèche, ce qui va permettre la diffusion des cryoprotecteurs. Ces conditions réunies pourraient permettre la vitrification des blastocystes de plus de 300 µm [18]. Les taux de gestation obtenus sont prometteurs : 71 % à 25 jours et jusqu’à 86 % si plus de 70 % du blastocèle est rétractée, que l’aspiration est faite en périphérie du trophoblaste et que l’embryon est vitrifié dans une paillette spéciale [12]. La micromanipulation permettant le collapsus du blastocèle est une réelle avancée dans la congélation des embryons de l’espèce équine.
En France, un kit comprenant tous les équipements pour la vitrification de quatre embryons (cryoprotecteurs, paillettes, etc.) et un transfert direct (sans sortir l’embryon de la paillette) après décongélation est disponible sur le marché(1). Ce kit permet de développer facilement et sans investissement important la vitrification sur le terrain pour des embryons de petite taille collectés à 6,5 jours. Toutefois, aucune publication scientifique n’existe à propos du taux de succès obtenu.
La vaccination anti-GnRH (gonadotropine releasing hormone) est une solution alternative à la castration ou à l’ovariectomie qui permet de supprimer le comportement sexuel non désiré de manière réversible. Le principe est d’injecter de la GnRH, conjuguée à une protéine à pouvoir antigénique, et un adjuvant immunostimulant. Les anticorps produits se lient à la GnRH endogène et l’empêchent de se fixer sur ses récepteurs. La sécrétion des gonadotropines FSH (follicle stimulating hormone) et LH (luteinizing hormone) est alors inhibée. Il en résulte une chute de la production de la testostérone chez le mâle entraînant une inhibition de la spermatogenèse et du comportement sexuel [29]. Chez la femelle, l’activité ovarienne est supprimée (pas de croissance folliculaire), et la progestérone reste basale ainsi que les œstrogènes. Il en résulte une inhibition du comportement sexuel également [22].
La vaccination anti-GnRH a plusieurs indications. C’est une solution alternative non invasive et réversible dans la plupart des cas à la castration chirurgicale chez l’étalon (3 étalons sur 27 n’ont pas retrouvé leur fertilité après 2 ans [7]). Aujourd’hui, contrôler le comportement sexuel de leurs juments est de plus en plus demandé par les propriétaires et représente un défi pour les vétérinaires. Un comportement sexuel indésirable peut entraîner des contre-performances et rendre la jument impossible à travailler ou à monter pendant ses chaleurs. De plus, le recours aux progestagènes est coûteux et astreignant. Aucune réglementation antidopage n’est définie à ce jour. Cependant, l’arrêté du 2 mai 2011, relatif aux substances et aux procédés mentionnés à l’article L. 241-2 du Code du sport, stipule que seuls les vaccins visant des agents infectieux ou leurs toxines sont autorisés (les autres substances intervenant sur le système immunitaire sont interdites) et que, de plus, les produits renfermant des hormones naturelles ou synthétiques et leurs analogues sont interdits. Les vaccins anti-GnRH entrent dans ces deux catégories. Le dépistage des anticorps anti-GnRH chez les animaux est aisé. Il n’est pas encore d’actualité, mais il pourrait l’être dans quelques mois ou quelques années. Il convient donc d’être prudent lors de l’utilisation de ces vaccins si les chevaux sont amenés à faire de la compétition ou des courses.
La formulation du vaccin destiné aux équidés (Equity®) est, à ce jour, disponible en Australie et en Nouvelle-Zélande avec pour indication l’induction d’un anœstrus chez des juments de loisirs ou de sport non destinées à la reproduction (car la réversibilité n’est que de 92 % dans une étude chez plus de 50 juments pendant 720 jours [4]). En Europe, seul le vaccin avec une autorisation de mise sur le marché (AMM) pour les porcs (Improvac®) est disponible depuis 2009. Son indication est la castration chimique des porcelets pour prévenir l’odeur d’urine de la viande de porc non castré.
L’injection de ce vaccin chez un équidé doit être réalisée avec le consentement éclairé du propriétaire de l’animal et sous la responsabilité du praticien, car, d’une part, il s’agit d’une utilisation hors AMM et, d’autre part, le vaccin porcin n’est pas constitué avec la même protéine porteuse, ni avec le même adjuvant de l’immunité que le vaccin équin, et il est doublement concentré en particules immunogènes [6]. Pour ces raisons, il est plus inflammatoire et à l’origine de davantage de réactions locales et générales : fièvre (90 %), gonflement au point d’injection (33 %), douleur au point d’injection (45 %). Ces effets s’amplifient lors de l’injection de rappel, avec une raideur de l’encolure (78 %) et une apathie (22 %) [22]. Une administration de phénylbutazone est donc recommandée pendant quelques jours, conjointement à la vaccination [7].
Pour les mâles, dans une étude menée en 2009 sur 5 étalons âgés de 8 à 15 ans ayant reçu trois injections à 4 et 8 semaines d’intervalle, tous ont présenté une baisse de la quantité et de la qualité du sperme après la seconde vaccination. Une diminution de la libido a été observée chez 4 des 5 étalons, 13 à 18 semaines après la première injection et pendant 10 à 32 semaines [23]. Cette vaccination serait plus fiable chez les jeunes étalons. Chez les animaux plus âgés, il convient de multiplier les injections et l’effet sur le comportement reste parfois peu marqué [29].
Pour les femelles, une étude menée en 2006 sur 9 juments a rapporté que toutes ont présenté une inhibition du comportement sexuel 8 semaines après la première injection, pendant 23 semaines au minimum. Ensuite, un retour à la cyclicité a été observé chez 5 juments, une croissance folliculaire sans cyclicité chez 3 autres et la dernière est restée en anœstrus pendant les 100 semaines de l’essai [22]. Une autre étude sur 51 juments classées en trois catégories d’âge (moins de 4 ans, de 5 à 10 ans et plus de 11 ans) a montré que, après deux injections à 35 jours d’intervalle, tous les animaux ont présenté un arrêt de la cyclicité à partir du 70e jour et que 92 % d’entre eux ont retrouvé leur cyclicité après 720 jours, les juments de moins de 4 ans ayant regagné leur activité cyclique significativement plus tardivement que celles de plus de 11 ans [4].
Enfin, des travaux réalisés en 2010 ont testé l’efficacité de la vaccination sur 21 juments et 10 étalons. 84 % des individus n’ont plus présenté le comportement sexuel non désiré [31].
En conclusion, toutes les études rapportent une efficacité variable de la vaccination en fonction des individus et il se peut que l’activité sexuelle reste inhibée. La vaccination anti-GnRH est donc déconseillée chez des individus pouvant être amenés à suivre une carrière de reproducteur par la suite. Le recours à cette solution alternative doit être considéré par les praticiens seulement si la reproduction et la compétition ne sont pas envisagées, et que, d’une part, l’animal présente un caractère sexuel non désiré et, d’autre part, le propriétaire ne souhaite pas prendre le risque d’une intervention chirurgicale. Des rappels annuels sont alors à envisager.
Chez les mâles, le dosage de l’hormone antimüllérienne (AMH) sérique est une solution alternative qui permet de diagnostiquer de façon plus précise la cryptorchidie lorsque le test de stimulation à l’hCG (human chorionic gonadotropin) n’est pas concluant (encadré 2).
La cryptorchidie correspond à l’absence de descente d’un ou de deux testicules dans le scrotum. Les testicules ectopiques sont alors inguinaux ou abdominaux.
L’AMH est sécrétée par les cellules de Sertoli et induit la régression des canaux de Müller au cours de la différenciation sexuelle du fœtus mâle. Elle est très fortement exprimée dans les testicules du fœtus, puis du jeune jusqu’à la puberté. En revanche, chez l’adulte âgé de plus de 3 ans, elle n’est exprimée que dans les testicules cryptorchides [3].
Le dosage de l’AMH n’est possible que si l’étalon est âgé de plus de 3 ans. Chez des individus âgés de 18 à 36 mois, le test de stimulation à l’hCG est recommandé.
Chez les femelles, le dosage de l’AMH sérique est une solution alternative qui permet de diagnostiquer les tumeurs des cellules de la granulosa (TCG) (encadré 3).
Les TCG sont les tumeurs ovariennes les plus fréquentes dans l’espèce équine (2,5 % des néoplasies). Elles modifient l’apparence de la gonade en un ovaire qui a perdu, le plus souvent, sa fosse ovulatoire et polykystique. Toutefois, elles adoptent parfois une forme moins évidente, qui laisse planer un doute lors de l’établissement du diagnostic. Des modifications comportementales telles que l’anœstrus, la masculinisation ou la nymphomanie sont observées également en cas de TCG.
Chez la jument, l’AMH est un marqueur des TCG avec une sensibilité significativement supérieure à celle de l’inhibine. La sensibilité du test AMH est de 95 % contre 85 % pour l’inhibine et seulement 52 % pour la testostérone [1]. L’AMH est produite par les cellules de la granulosa des petits follicules en croissance et des follicules antraux. Son dosage est inférieur à 4 ng/ml chez les juments saines (qu’elles soient en œstrus, en diœstrus ou en gestation) et supérieur à 4 ng/ml chez les animaux atteints de TCG [1, 2].
L’université de Davis, en Californie, propose pour valeurs de référence un dosage de l’AMH sérique supérieur à 4,2 ng/ml chez la jument atteinte de TCG et supérieur à 0,15 ng/ml chez le mâle cryptorchide.
Deux possibilités s’offrent au praticien : envoyer un prélèvement aux États-Unis ou tenter de trouver un laboratoire en France.
Pour travailler avec l’université de Davis, il convient d’envoyer 1 ml de sérum via UPS ou Chronopost International® avec un pack réfrigéré, surtout en été, accompagné d’un formulaire téléchargé depuis Internet et d’un paiement (60 $). Toutes les informations sont disponibles sur le site Internet de l’Université(2).
Le test mis en œuvre dans les publications est l’Active AMH-Elisa #DSL-10-1440, utilisé chez l’homme(3). L’AMH ne présente pas de particularité structurale en fonction de l’espèce. Le recours au dosage en France dans un laboratoire est envisageable en prenant soin, au préalable, de s’assurer du test qui sera employé (et que le laboratoire a établi ses propres valeurs de référence).
La technique d’ICSI, solution alternative à la fécondation in vitro (FIV), a été rapportée pour la première fois avec succès chez le cheval en 1996 [28]. Elle permet de produire des embryons en utilisant des étalons ou des juments peu fertiles, voire de conserver le potentiel génétique d’animaux qui disparaissent trop tôt. Les embryons produits par ces techniques de reproduction assistée sont ensuite transférés dans l’oviducte par voie chirurgicale ou transcervicale dans les cornes utérines en fonction de leur stade de développement. La fécondation in vitro conventionnelle chez le cheval est longtemps restée problématique car les spermatozoïdes ne traversent pas efficacement la zone pellucide. Pour cela, ces derniers doivent accomplir la réaction acrosomique (relargage des enzymes contenues dans l’acrosome) et acquérir une hypermobilité (mouvements frénétiques et localisés des spermatozoïdes). Les milieux classiques de capacitation utilisés dans les autres espèces, contenant du calcium, des protéines et du bicarbonate, n’induisent pas d’hypermobilité chez l’étalon. L’ajout de procaïne a permis d’obtenir, récemment et avec succès, des fécondations in vitro de manière reproductible [19]. Face aux difficultés rencontrées lors de fécondation in vitro et à l’importance de l’ICSI en procréation médicalement assistée en médecine humaine, les recherches se sont focalisées sur le développement de l’ICSI chez le cheval. L’atout de cette méthode est de contourner plusieurs étapes de la fécondation puisqu’elle consiste en l’injection d’un unique spermatozoïde directement au sein du cytoplasme d’un ovocyte :
– la capacitation (processus pendant lequel le spermatozoïde acquiert son pouvoir fécondant dans les voies génitales femelles) ;
– la réaction acrosomique (relargage des enzymes de l’acrosome pour permettre au spermatozoïde de traverser la zone pellucide de l’ovocyte) ;
– la pénétration de la zone pellucide ;
– la fusion des membranes.
L’ovocyte utilisé pour réaliser une ICSI doit être mature et se trouver en métaphase de deuxième division méiotique (un seul globule polaire émis). Il est dénudé du cumulus oophorus (couches de cellules de la corona radiata et de la granulosa) qui l’entoure. Il a été obtenu généralement par ponction échoguidée de follicules chez une jument en chaleur ou dans les heures qui suivent la mort afin de conserver le potentiel génétique. Dans ce cas, l’ovocyte doit subir une maturation in vitro.
Le spermatozoïde étant directement injecté au sein de l’ovocyte, il peut être mobile ou immobile, provenir d’un éjaculat, d’une ponction de l’épididyme ou du testicule, avoir été fraîchement collecté ou avoir subi une congélation [8, 9].
Pour mesurer l’efficacité de la technique d’ICSI, deux critères sont principalement utilisés : le taux de clivage et le taux de blastocystes formés. Le taux de clivage, observé après 2 à 3 jours de culture, correspond au nombre de zygotes ayant débuté leur mitose divisé par le nombre d’ovocytes qui ont été injectés. Le taux de blastocystes, observé après 7 à 10 jours de culture, représente le nombre de blastocystes formés divisé par le nombre d’ovocytes qui ont été injectés. À l’heure actuelle, chez les chevaux, un taux de clivage de 20 à 65 %, selon les études, et un taux de blastocystes inférieur à 15 % peuvent être obtenus après ICSI.
En 2002, une étape a été franchie en matière d’ICSI grâce à l’association avec la technique Piezo : des vibrations sont transmises dans la pipette d’injection pour immobiliser le spermatozoïde, traverser la zone pellucide et percer la membrane plasmique de l’ovocyte avant injection.
Toutefois, l’utilisation du mercure dans cette méthode Piezo peut avoir un impact néfaste sur l’ADN des gamètes. C’est pourquoi, en 2012, une équipe a testé un laser pour percer la zone pellucide de nombreux petits trous adjacents pour la fragiliser. Le spermatozoïde est alors immobilisé en appuyant sur sa queue et la membrane plasmique est percée à l’aide d’une pipette biseautée. Cette tentative a donné lieu à un taux de clivage supérieur (81 %) et à un taux de blastocystes inférieur (6,3 %) par rapport à l’association avec la technique Piezo. Toutefois, ces résultats ne sont pas statistiquement différents. Il apparaît qu’un trou persiste dans la zone pellucide, lequel pourrait expliquer l’obtention d’un taux de blastocystes plus faible [27].
L’ICSI est désormais disponible sur le marché en Europe, au sein du laboratoire du Dr Cesare Galli, à Crémone, en Italie, mais reste réservée à des juments et à des étalons d’exception en raison de son coût et de sa faible rentabilité.
Lorsque l’ICSI est réalisée post-mortem, sa réussite dépend de l’âge de la jument donneuse d’ovocytes, mais aussi du temps et de la température de transport de l’ovaire. Choi et coll. ont standardisé les températures d’envoi en fonction du temps de transport d’après une étude rétrospective entre 2006 et 2009. Si le transport dure moins de 2 heures, une température proche de celle du corps est conseillée. S’il est plus long, il est alors préférable de transporter les ovaires à 15 °C [11]. La réussite d’une ICSI dépend également de la qualité de la semence de l’étalon, même si l’immobilité n’est pas un critère d’exclusion d’un étalon vis-à-vis de la technique d’ICSI. Préalablement à l’injection, le sperme d’un étalon devrait être testé sur des ovocytes équins issus d’ovaires d’abattoirs afin d’en connaître la fertilité in vitro (taux de clivage et de blastocystes formés), sachant qu’il existe une bonne corrélation entre la fertilité in vivo et la fertilité in vitro [13, 16]. Toutefois, cette expérimentation est laborieuse car le matériel est peu abondant. Pour pallier cette difficulté, des ovocytes porcins ont été utilisés. Lorsqu’ils sont injectés avec du sperme équin, ils représentent un bon modèle pour déterminer les taux de fécondation et de clivage [13].
Les embryons produits in vitro ne présentent pas exactement les mêmes caractéristiques morphologiques que ceux in vivo (la capsule ne se forme pas in vitro, les embryons sont plus petits, les dommages membranaires, plus importants, etc.). Toutefois, les embryons produits par ICSI conduisent à des gestations et à la naissance de poulains viables [8].
De nombreuses techniques existent sur le marché, mais elles ne sont pas toutes encore disponibles en France. Toutefois, cette situation est susceptible d’évoluer rapidement et chaque vétérinaire va devoir adapter ses pratiques aux nouvelles biotechnologies qui seront, demain, à sa portée.
(1) EquiPro® Vit-Kit® de chez Minitübe (140,75 € HT + 35 € HT de transport) : http://www.minitube.de/DE_eng/Products-Services/Embryo-Transfer/Media-for-Equine-ET/EquiPro-R-Vit-Kit-For-Direct-Transfer-Vitrification
(3) Diagnostic Systems Laboratories, Webster, Texas, États-Unis.
Aucun.
> Les embryons de moins de 300 µm résistent mieux à la cryoconservation, mais de récents travaux ont montré qu’il est possible de congeler des blastocystes après avoir ponctionné le fluide du blastocèle.
> La vaccination anti-GnRH est une solution alternative à l’intervention chirurgicale, réversible dans 90 % des cas, pour inhiber un comportement sexuel non désiré. Il n’est cependant pas recommandé de l’appliquer chez des animaux amenés à se reproduire un jour et/ou participant à des compétitions.
> Le dosage de l’hormone antimüllérienne (AMH) est un outil d’avenir pour diagnostiquer les tumeurs des cellules de la granulosa chez la jument et la cryptorchidie en cas de doute chez un cheval âgé de plus de 3 ans.
> L’ICSI (intracytoplasmic sperm injection) permet de produire des embryons en utilisant des étalons ou des juments peu fertiles, voire de conserver le potentiel génétique d’animaux qui disparaissent trop tôt.
Définitions
> Congélation lente : descente de température programmée et équilibrée entre la déshydratation et la formation de cristaux de glace intra- et extracellulaires.
> Vitrification : passage d’un corps de la phase liquide à une phase solide proche du verre induite par une descente de température excessivement rapide. Aucun cristal de glace ne se forme.
Principe de la congélation : les cryoprotecteurs
> Cryoprotecteurs intracellulaires
Ils pénètrent dans les cellules et remplacent l’eau intracellulaire. Ils limitent ainsi la formation de cristaux de glace qui endommagent les membranes et le cytosquelette, et compromettent la survie de l’embryon.
Leur incorporation s’effectue par étapes ou bains de concentrations croissantes dans lesquels l’embryon est placé.
> Cryoprotecteurs extracellulaires
• De fort poids moléculaire (BSA [bovine serum albumin], sérum de veau fœtal), ils protègent les cellules en limitant la formation de cristaux de glace.
• De faible poids moléculaire (sucrose), ils augmentent la pression osmotique du milieu et limitent les mouvements d’eau à travers les membranes.
> Application aux techniques de congélation
• Congélation lente : glycérol, éthylène glycol, DMSO (diméthylsulfoxide), 1,2-propanédiol, méthanol, etc., à raison d’une concentration maximale de 10 % atteinte en plusieurs bains de quelques minutes.
• Vitrification : éthylène glycol et DMSO à une concentration de 15 à 40 %. Ils sont employés en association avec du sucrose. Pour limiter la toxicité des cryoprotecteurs, l’embryon reste moins d’une minute dans les bains les plus concentrés.
Après être passé dans les bains de cryoprotecteurs, l’embryon est monté dans une paillette du même type que celle qui est utilisée pour le transfert d’embryon pour la congélation lente, et dans des paillettes étirées et ouvertes (open pulled straw) pour la vitrification. Ce système ouvert permet d’appliquer une vitesse de refroidissement supérieure.
Courbes de descente de la température
> En congélation lente, l’embryon est placé dans le congélateur et le programme est lancé pour une série d’embryons (figure 1).
Durant le programme, un seeding doit être effectué, ce qui signifie que la cristallisation est induite pour limiter l’inévitable phénomène de surfusion qui survient lorsqu’un corps passe de l’état liquide à solide. Lors de surfusion, le corps est dans un état instable. Il est encore à l’état de liquide alors qu’il est à une température inférieure à sa température de cristallisation. En pratique, le seeding est réalisé vers – 6 ou – 7 °C en plaçant une tige de métal, préalablement plongée dans l’azote liquide, en contact avec la paillette contenant l’embryon.
La vitesse de refroidissement est ensuite diminuée jusqu’à atteindre – 30 °C. Au cours de cette étape, l’embryon subit également une deshydratation. Le cycle de congélation se termine quand la température de – 30 °C est atteinte. Les paillettes sont ensuite plongées dans l’azote liquide.
> Lors de vitrification, la paillette contenant l’embryon est directement plongée dans l’azote liquide. La vitesse de refroidissement est alors de – 2 500 à – 20 000 °C/min en fonction du type de système utilisé (fermé ou ouvert) (figure 2).
Comparaison des deux méthodes
La congélation lente requiert peu de technicité de la part de l’opérateur et les cryoprotecteurs utilisés à plus faible concentration sont moins toxiques. En revanche, la vitrification est très facile à mettre en place sans investissement d’un congélateur programmable et a permis de cryoconserver des embryons de plus de 300 µm.
> Palpation du scrotum
En cas de doute, une tranquillisation peut rendre un testicule inguinal accessible.
> Palpation transrectale
L’anneau vaginal de 1 à 1,5 cm de diamètre est palpable. Il convient alors de rechercher le canal déférent qui passe dans l’anneau vaginal. Si tel est le cas, le testicule est probablement inguinal. Sinon, il est vraisemblablement abdominal.
> Échographie inguinale et/ou transrectale après tranquillisation (sonde linéaire de 5 MHz)
Pour la partie inguinale, il convient de placer la sonde longitudinalement sur l’anneau inguinal externe du côté du testicule cryptorchide. L’échographie transrectale débute sur le plancher du bassin pour remonter de chaque côté. Le tissu testiculaire présente un aspect échogène homogène.
> Dosages hormonaux : Test de stimulation à l’hCG (human chorionic gonadotropin), ou comment distinguer les mâles cryporchides des animaux castrés.
L’injection d’hCG augmente la synthèse et la sécrétion de testostérone par les cellules de Leydig du testicule. La réponse à la stimulation dure plus longtemps que la stimulation épisodique par la LH (luteinizing hormone) endogène. Une valeur basale de testostérone est donc comparée à une valeur 1 heure, 3 heures ou 24 heures après la stimulation.
Il est recommandé d’administrer 10 000 UI d’hCG par voie intraveineuse lente.
Si le cheval à tester est âgé de moins de 18 mois, il ne produira pas assez de testostérone en réponse à la stimulation. Ce phénomène peut également être observé chez un individu cryptorchide abdominal bilatéral.
> Palpation transrectale
L’ovaire atteint est plus dur, sa taille augmente, la fosse ovulatoire n’est plus palpable et l’ovaire controlatéral est anormalement petit.
> Échographie transrectale (sonde linéaire de 5 MHz)
À l’échographie, l’image est typiquement celle d’un ovaire multikystique. Néanmoins, dans quelques cas, l’ovaire peut seulement être un peu plus gros, et présenter un aspect solide ou un unique follicule de grande taille. Le diagnostic différentiel inclut alors :
– un hématome ovarien ;
– un abcès ovarien ;
– des follicules de transition printanière ;
– un kyste para-ovarien ;
– une gestation.
> Dosages hormonaux
Les tumeurs des cellules de la granulosa sont hormono-sécrétantes. L’inhibine est élevée chez 85 % des juments atteintes, la testostérone chez 50 % et la progestérone reste basale. La testostérone n’est donc pas un indicateur très fiable et l’inhibine est une protéine fragile qui nécessite d’être dosée immédiatement ou après conservation de 24 heures au maximum à 4 °C. Aucun laboratoire ne dose l’inhibine équine en France.
> Analyse histopathologique
Elle permet un diagnostic de certitude après l’exérèse de l’ovaire.
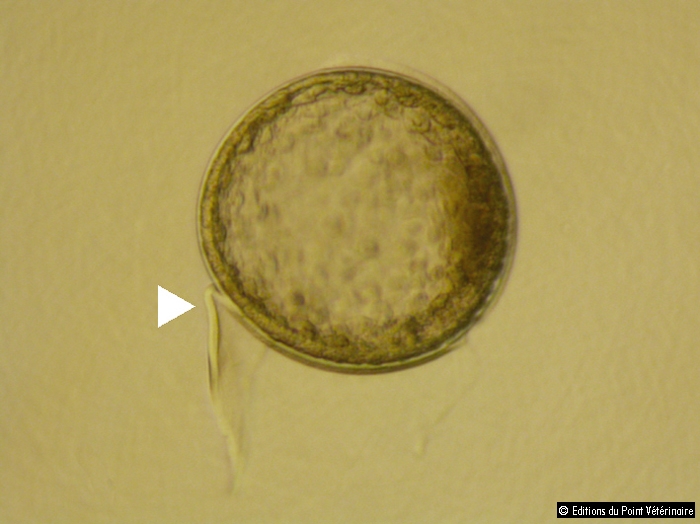
Photo 1. Observation à la loupe binoculaire d’un blastocyste équin collecté 6,75 jours après l’ovulation (inférieur à 300 µm), dont la zone pellucide est endommagée (tête de flèche) (grossissement × 50).
Cliché : A. Allard.